诺辉健康旗下幽门螺杆菌自测器“幽幽管” 18日首发上线医械日报
● 国家药监局发布以医疗器械作用为主的药械组合产品等2项注册审查指导原则的通告
1月17日,国家药品监督管理局组织制定了《一次性使用高压造影注射器及附件产品注册审查指导原则》《金属接骨板内固定系统产品注册审查指导原则(2021年修订)》《可降解镁金属骨科植入物注册审查指导原则》《微导管注册审查指导原则》《一次性使用内窥镜注射针注册审查指导原则》《人工晶状体注册审查指导原则》等6项注册审查指导原则。(来源:国家药品监督管理局)
《一次性使用高压造影注射器及附件产品注册审查指导原则》适合使用的范围:《医疗器械分类目录》中06医用成像器械目录下05X射线磁共振造影注射装置。
《金属接骨板内固定系统产品注册审查指导原则(2021年修订)》适合使用的范围:分类编码中的13-01-01产品,管理类别为Ⅲ类。
《可降解镁金属骨科植入物注册审查指导原则》适合使用的范围:分类编码为13-01-01,管理类别为Ⅲ类。
《微导管注册审查指导原则》适合使用的范围:《医疗器械分类目录》(2017年第104号)中分类编码为03-13-26的微导管。《一次性使用内窥镜注射针注册审查指导原则》适合使用的范围:《医疗器械分类目录》中14注输、护理和防护器械目录下01注射、穿刺器械项下06注射针。
《人工晶状体注册审查指导原则》适合使用的范围:产品管理类别为第三类,分类编码为16-07-01的产品
为加强对药械组合产品注册工作的监督和指导,进一步鼓励具有临床价值的药械组合产品上市,构建适合我国国情的药械组合产品的管理模式,国家药品监督管理局将药械组合产品技术评价作为监管科学研究项目,组织制定了《以医疗器械作用为主的药械组合产品注册审查指导原则》《以医疗器械作用为主的药械组合产品中药物定性定量及体外释放研究注册审查指导原则》等2项指导原则。(来源:国家药品监督管理局)

1、诺辉健康旗下幽门螺杆菌自测器“幽幽管” 18日在天猫医药健康首发上线
诺辉健康旗下适用于“消费者自测”的幽门螺杆菌检测新品幽幽管,1月18日在阿里健康旗下天猫医药健康平台首发,售价149元。(来源:中国证券报)
幽幽管于2022年1月6日获批上市,是国内首个幽门螺杆菌自测产品。国家药监局器审中心公布的评审报告数据显示,幽幽管产品预期用途“既适用于专业医务人员在医疗单位做幽门螺杆菌抗原检测,也适用于消费者自测”。幽幽管以呼气法为金标准,在浙江大学医学院附属邵逸夫医院、浙江省人民医院和北京大学首钢医院三家三级临床医院,共纳入疑似幽门螺杆菌感染有效受试者1644例,敏感性达到96.5%,特异性达到99.1%,受试者自测结果与专业技术人员检测结果对比,符合率达到100%。


海利生物宣称,近日全资子公司上海捷门生物技术有限公司(简称“捷门生物”)尿液多项质控品(体外诊断试剂)收到上海市药品监督管理局颁发的《医疗器械注册证》。(来源:上海证券交易所)

该产品的上市进一步丰富了捷门生物检测试剂的种类,有利于满足多种的市场需求,对公司未来发展具有非消极作用,但短期对业绩不会产生重大影响。
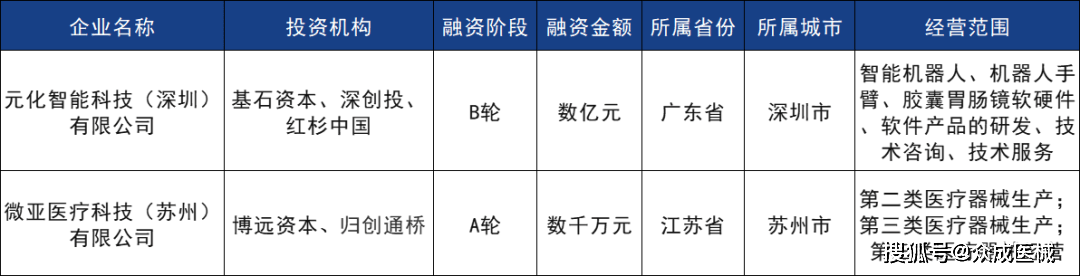
本轮融资将助力公司骨科手术机器人的全面商业化布局,加速消化道产品和经自然腔道手术机器人的临床进度,并推动公司自研协作机械臂的终期测试和商业应用。
近日,国内领先的微创血管介入手术机器人企业微亚医疗完成数千万元A轮融资。本轮融资由博远资本领投、国内血管介入龙头上市公司归创通桥作为战略投资人共同投资,义诚资本担任长期独家财务顾问。本轮融资资金将用于公司血管介入手术机器人研发迭代、产品适应症拓展及加速临床推进。
微亚医疗与归创通桥签订战略合作协议。归创通桥将基于在血管介入领域的资源持续赋能,共同加速微亚医疗血管介入手术机器人在产品研制、临床合作、注册申报及商业化进展等工作,实现双方产品与业务的协同发展,满足血管介入手术中更广泛的临床需求。————欢迎转发分享,转载请注明:“众成医械”。更多医械行业前沿资讯、数据干货、专业报告、中标信息,关注械企查小程序!
平台声明:该文观点仅代表作者本人,搜狐号系信息发布平台,搜狐仅提供信息存储空间服务。



